Inhoudsopgave
- Ten geleide
- De geboorte van de radiologie
- Hersenfunctie in beeld
- Mevrouw W. heeft een hersentumor
- Röntgen’s revolutie voorbij
- Het technische ziekenhuis
- Waarom we moeten tellen
- Big Data
- De uitstervende algemene radioloog
- De menselijke factor
- De weerbastige werkelijkheid van de klinische praktijk
- De weg naar implementatie
- Het beeld dat telt
- Dankwoord
Ten geleide

Inaugurale rede uitgesproken op vrijdag 14 juni 2019 aan de Erasmus Universiteit Rotterdam door prof. dr. Marion Smits ter aanvaarding van de leerstoel Toegepaste Beeldvorming van de Fysiologie van het Zenuwstelsel.
Video van de rede: https://youtu.be/NuPW2FBd6p0
De geboorte van de radiologie
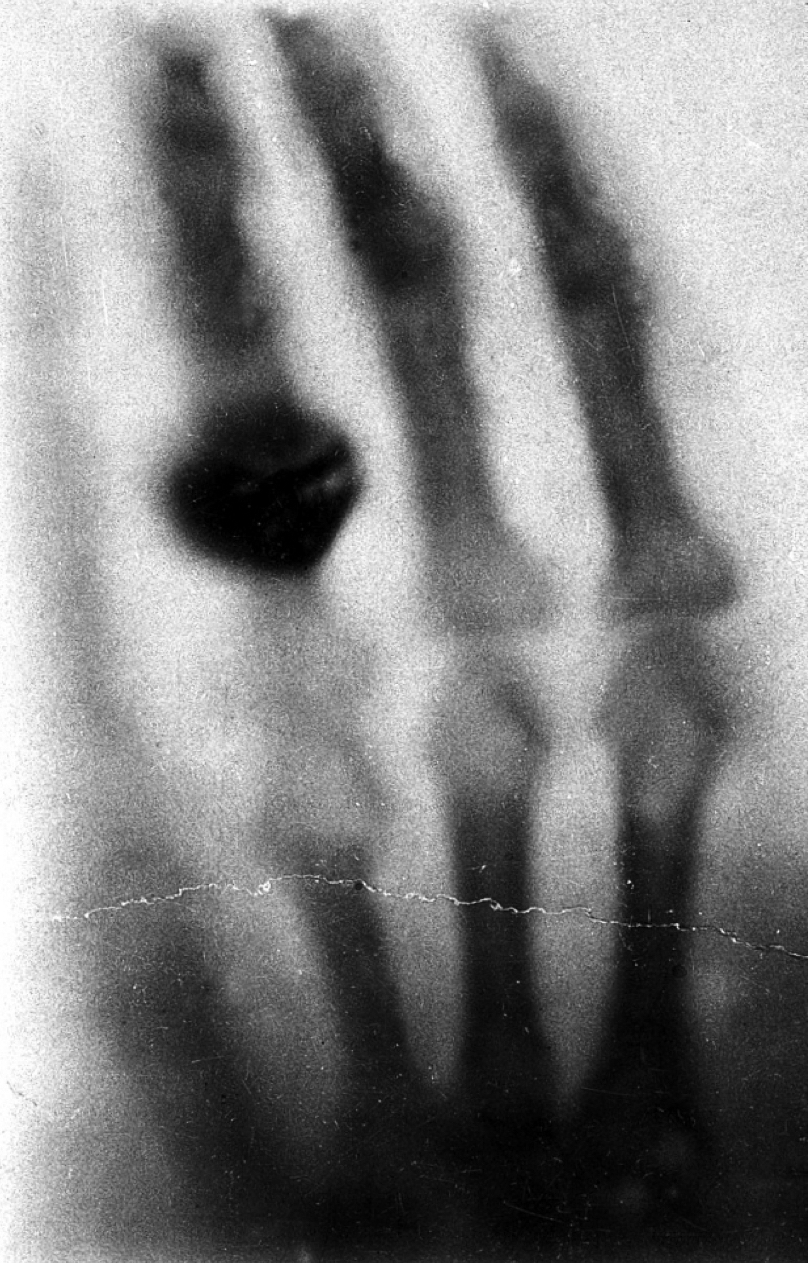
Het is vrijdag 8 november 1895, laat in de middag, als Wilhelm Conrad Röntgen plotseling het stralingsgevoelige scherm in zijn verduisterde laboratorium ziet oplichten. Dat weekend gaat hij niet naar huis, noch de erop volgende weken: onafgebroken experimenteert hij met dit fenomeen van zogenaamde fluorescentie. Hij eet, slaapt, leeft in zijn laboratorium. Op enig moment stapt hij zelf in de stralenbundel en ziet zijn eigen skelet op het scherm verschijnen: een moment dat even opzienbarend als vreeswekkend moet zijn geweest. Twee weken later, op 22 november 1895, neemt hij dan de eerste officiële röntgenfoto, van de hand van zijn vrouw. Het eerste beeld in de radiologie is geboren.
Het is denk ik onmogelijk om de impact van deze ontdekking te overschatten.
Tot ruim een eeuw geleden wisten we enkel informatie over het innerlijk van de mens te verkrijgen door het lichaam daadwerkelijk te openen, zoals te zien op deze anatomische les van Dr. Nicolaes Tulp, afgebeeld door Rembrandt in het begin van de 17e eeuw.

Nu is de beeldvormende technologie zo ver ontwikkeld dat de radiologische, en niet de anatomische afbeelding onze kennis van de anatomie bepaalt en verrijkt.

Dit kan niet beter worden geillustreerd dan met dit beeld: dit is het boek Gray’s anatomy uit 2008 – het leidende tekstboek over de menselijke anatomie, grotendeels gebaseerd op secties van overledenen.
Hierop preikt nu dit beeld van de vezelbanen die de diverse taalgebieden in de hersenen verbinden, gebaseerd op een MRI scan. Een scan, die in een paar minuten kan worden verkregen, bij ieder van ons zoals we hier in levende lijve zitten.
Dit zijn de beelden waar ik mij in mijn vakgebied, als neuroradioloog, en mijn leerstoel in de zogenaamde fysiologische beeldvorming mee bezig houd.
Wat is fysiologische beeldvorming? Hiervoor moeten we terug naar het verschil tussen anatomie en fysiologie.
Hersenfunctie in beeld
Anatomie is de structuur van een organisme of orgaan; dit is waar de overgrote meerderheid van radiologische beeldvorming op is gericht. Fysiologie is de functie van levende organismen, alle processen die binnen de structuur plaatsvinden. Dus bijvoorbeeld de doorbloeding en het energieverbruik van weefsel. Wanneer ziektes ontstaan, zien we dit vaak als eerste als een verandering of afwijking in deze processen. In het vroege stadium van een tumor bijvoorbeeld, is er al direct meer bloed, zuurstof en suiker nodig om de tumor te laten groeien. Pas wanneer dit al een tijdje heeft plaatsgevonden en de tumor tot een bepaalde omvang is gegroeid, gaan we deze ook als een structurele afwijking zien.
Hoewel veel ziekten zich dus aanvankelijk op het niveau van de fysiologie, de processen, ophouden, is onze aandacht binnen de radiologie voornamelijk gericht op de anatomie, de structuur. Met fysiologische beeldvorming richten we ons dus op het ziekteproces zelf. Hierdoor kunnen we vaak veel eerder en meer zeggen over de ziekte dan met structurele beeldvorming.
Mevrouw W. heeft een hersentumor
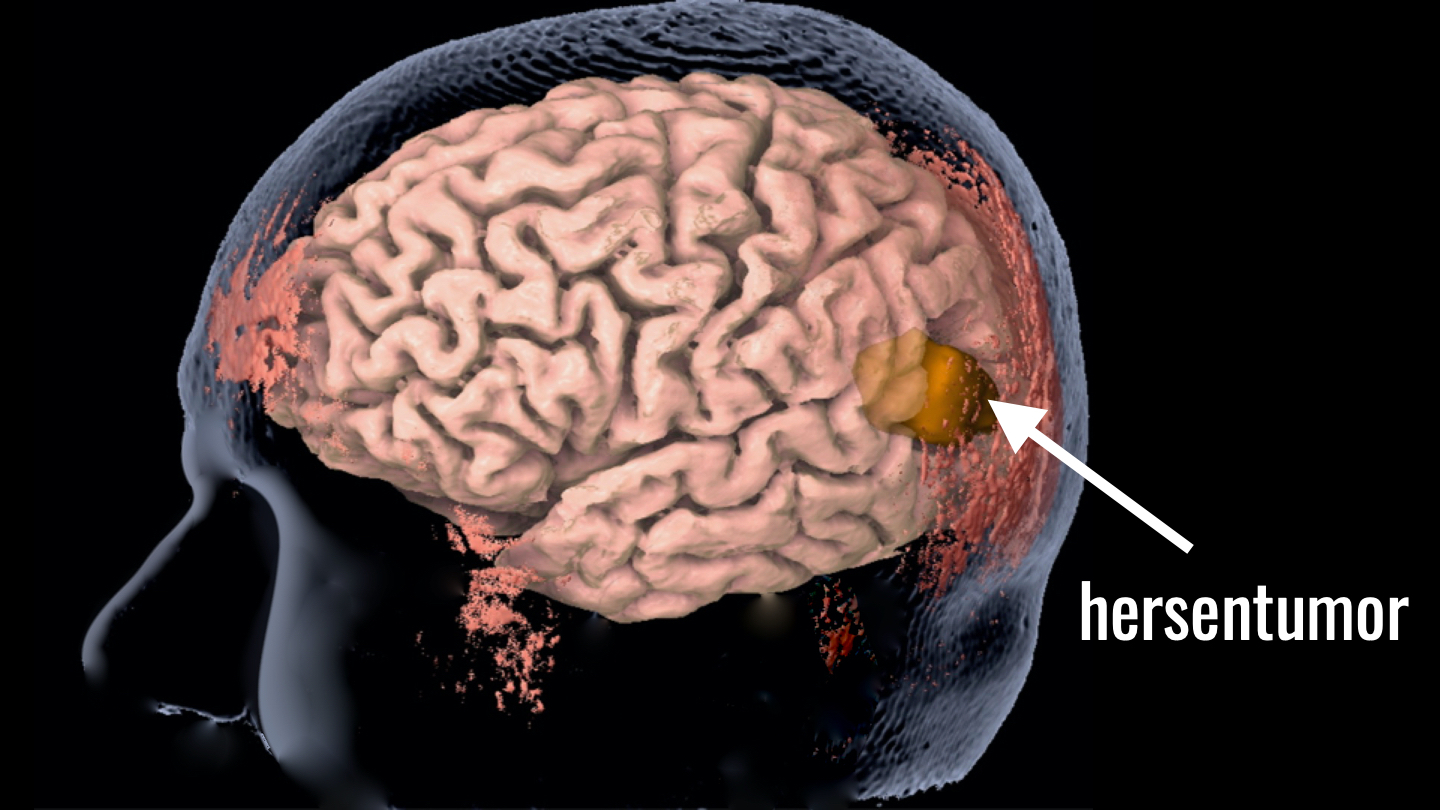
Mevrouw W. is 41 jaar. Ze heeft een hersentumor maar heeft eigenlijk weinig klachten. Het kan zijn dat de tumor voorlopig niet heel snel zal groeien, maar dat is niet zeker: om dat te weten is onderzoek van het weefsel van de tumor nodig. De neurochirurg wil haar daarom opereren, om zoveel mogelijk tumor weg te halen en zo ook weefsel voor de diagnose te verkrijgen. Maar ze twijfelt. Ze is bang voor een verlamming als er tijdens de operatie belangrijke hersengebieden beschadigd worden. En misschien kan niet eens alle tumor weggehaald worden, waardoor een operatie op dit moment misschien niet eens zo zinvol is.
Er spelen hier twee belangrijke problemen die we regelmatig in de klinische praktijk tegenkomen.
Ten eerste, de vraag waar de belangrijke functies in de hersenen zich bevinden.
We kunnen op deze anatomische MRI dan wel heel precies zien wáár in de hersenen zich de tumor bevindt, maar we kunnen hiermee niet zien of er hersenfuncties in gevaar zijn.
Het tweede probleem is dat we op basis van de beeldvorming niet zeker kunnen zeggen wat voor tumor het precies is: gaat deze heel snel groeien, en is het dus belangrijk om snel te opereren? Of is de groei langzaam, en is het dus mogelijk om nog even te wachten?
Om dit zeker te weten is zoals gezegd weefsel van de tumor zelf nodig. En dat krijgen we alleen met een operatie. Hiermee bevinden we ons dus in een patstelling: voor de beslissing tot ingrijpen moeten we dus sowieso ingrijpen.
Met fysiologische beeldvorming proberen we deze problemen op te lossen.
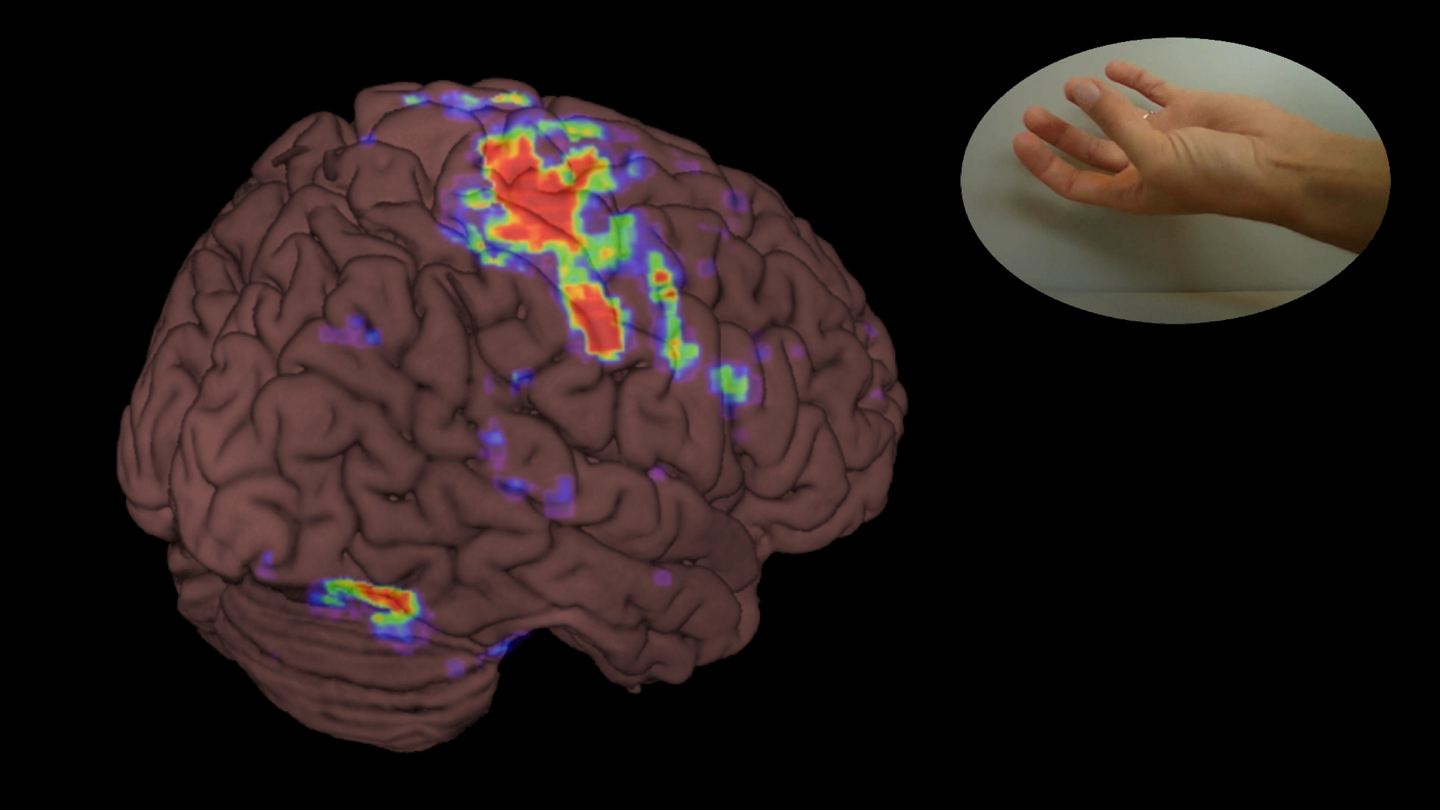
Hersenfuncties kunnen we in beeld brengen met functionele MRI. Deze techniek hebben we zo’n 15 jaar geleden in het Erasmus MC geïntroduceerd en dit was het begin van mijn onderzoekslijn.
Met functionele MRI laten we iemand in de scanner een bepaalde taak uitvoeren, zoals het bewegen van de vingers. Op die manier kunnen we heel nauwkeurig bepalen waar zich bijvoorbeeld het motorische gebied in de hersenen bevindt. Dit kan helpen bij het plannen van de operatie, en helpt bij het informeren over de risico’s op beschadiging en uitval zoals een verlamming.
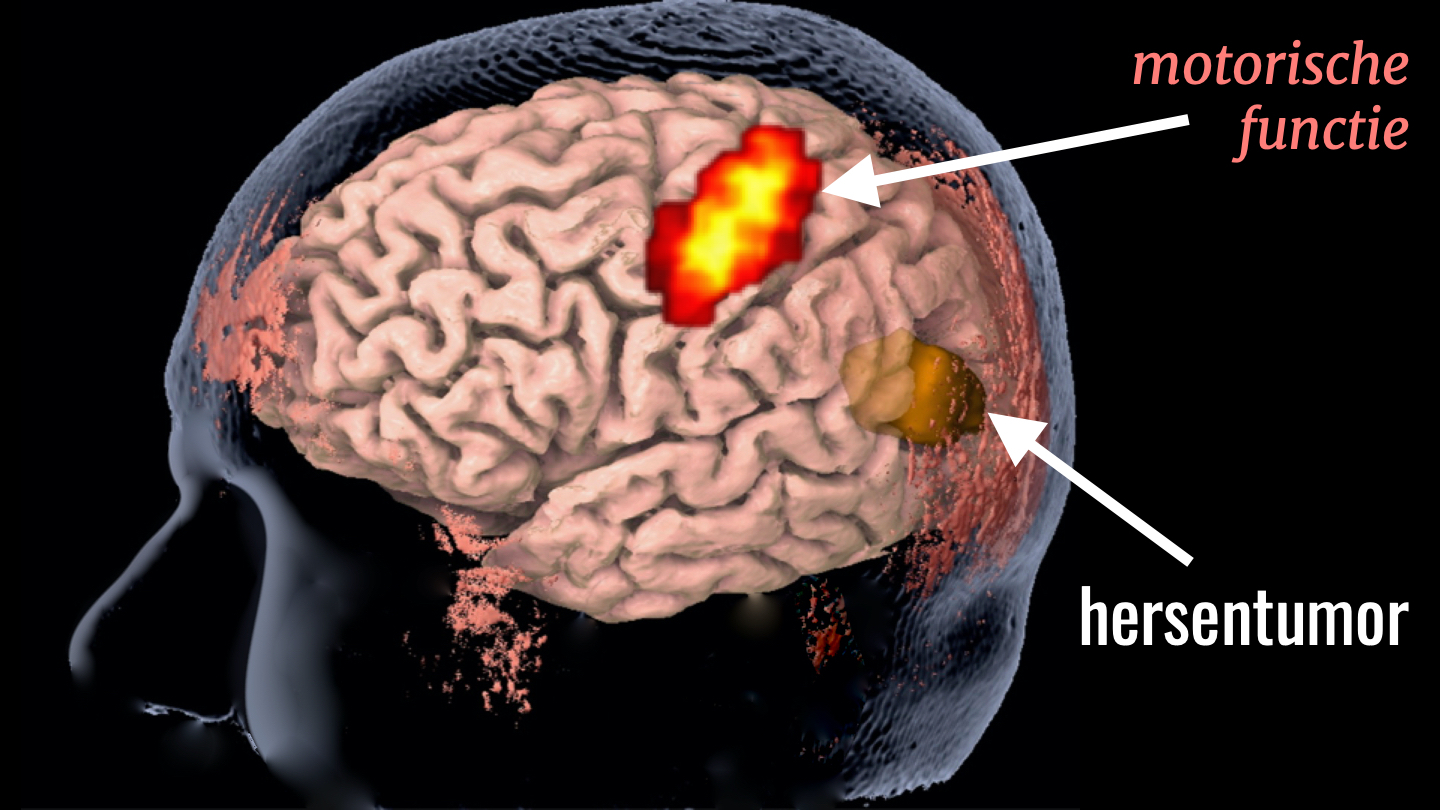
Dit zijn de beelden van mevrouw W. U kunt hier zien dat de tumor zich gelukkig op enige afstand van het motorische gebied bevindt, waardoor er weinig risico is op een verlamming.
Röntgen’s revolutie voorbij
Het tweede probleem, wat voor tumor het is, is ingewikkelder. Sinds jaar en dag is de gouden standaard van de diagnose van een hersentumor een beoordeling op cellulair en nu zelfs ook op moleculair/genetisch niveau. Dit vereist zoals gezegd weefsel. Wat dat betreft bevinden we ons dus eigenlijk nog in de tijd van Rembrandt: we moeten nog steeds het lichaam openen om een diagnose te kunnen stellen.
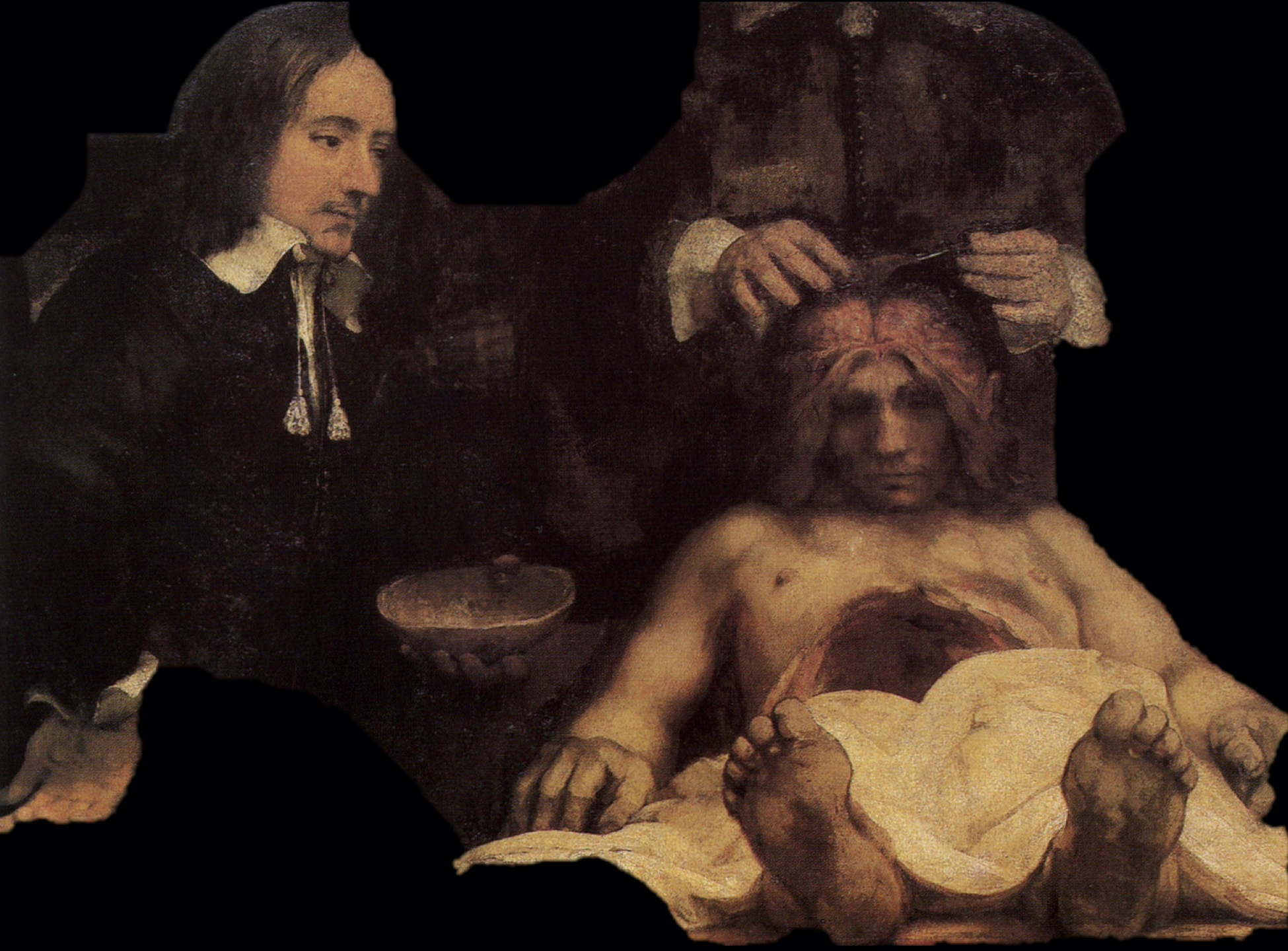
Onze huidige methoden zijn natuurlijk wel wat minder barbaars, maar in essentie is de revolutie die Röntgen teweeg heeft gebracht op het niveau van anatomische inzichten blijven steken.
Een van de meest toonaangevende MRI onderzoekers van dit moment, Mark Griswold, stelt dit wat provocatief als volgt:
“Every biopsy is a failed imaging experiment.”
Ieder biopt – het verkrijgen van weefsel – is een falen van onze beeldvorming. Immers, als we al met beeldvorming de juiste diagnose kunnen stellen, dan is een biopt, puur en alleen ter verkrijging van weefsel voor diagnostiek, niet meer nodig. Dit is het doel van onder andere onze iGENE studie, gefinancierd door het Koningin Wilhelmina Fonds Kankerbestrijding. Hierin proberen we op basis van heel veel beeldkenmerken het genetische profiel van een hersentumor te voorspellen.
We zijn echter nog lang niet zover dat we als het ware ‘virtuele pathologie’ kunnen bedrijven met radiologische beeldvorming.
Maar hoe werken we hier dan wel naar toe?
Ik denk dat er in ieder geval drie dingen belangrijk zijn. Ten eerste: technologische innovatie in beeldvorming. Ten tweede: kwantificatie. En ten derde: data en data-analyse.
Het technische ziekenhuis
Om te beginnen, innovatie in beeldvorming. Welke technieken hebben we nu al voorhanden? U heeft al gezien dat we de functie van de hersenen in beeld kunnen brengen met functionele MRI. Ook kunnen we de vezelbanen binnen de hersenen afbeelden.
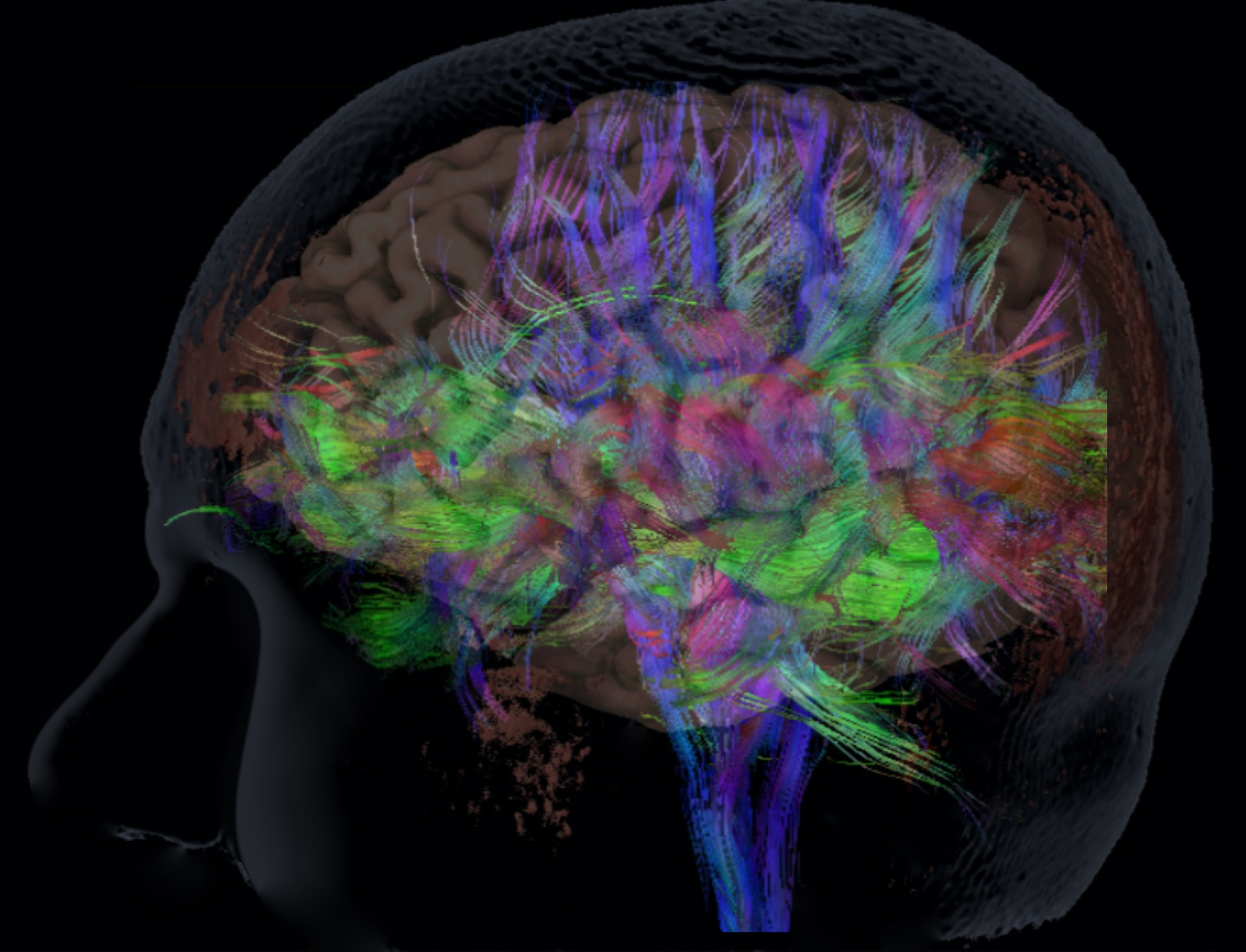
Ook deze zijn van groot belang voor een operatie, want het doornemen van de verbinding – het doorknippen van de bekabeling als het ware – kan net zulke ernstige gevolgen hebben voor de patiënt als het beschadigen van het functionele hersengebied zelf.
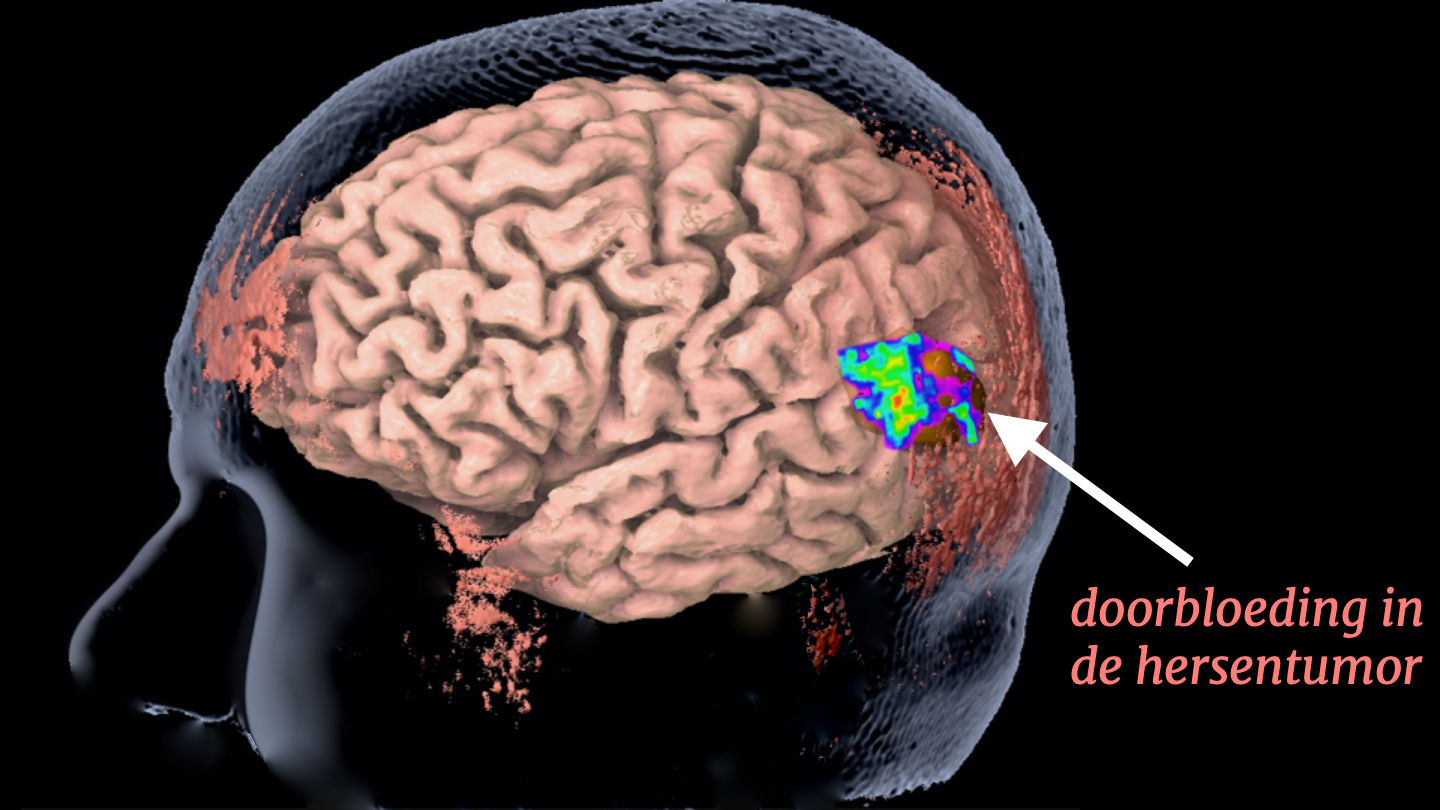
Ik noemde verder al dat doorbloeding een belangrijk fysiologisch proces is, dat ons kan helpen meer over een ziekteproces te leren en de ziekte te diagnosticeren. We weten bijvoorbeeld dat hersentumoren over het algemeen snel gaan groeien zijn als ze sterk doorbloed zijn.
Dit is de doorbloeding in de tumor van onze patiënte, waarbij de koele kleuren aangeven dat de doorbloeding relatief laag is. Waarschijnlijk zal de tumor nu dus nog niet heel snel gaan groeien.
Een ander proces waar we naar kunnen kijken is de energiehuishouding van de tumor. Als een tumor groeit, dan kost dat veel energie. U kent misschien wel de PET scan: hierbij wordt het energieverbruik van een tumor gemeten door radioactief suiker toe te dienen en de straling ervan te meten. Maar dat kan ook anders. Met een gloednieuwe MRI techniek, de zogenaamde glucoCEST MRI, kunnen we de opname van gewoon suiker in de hersenen zien, zonder straling en een stuk goedkoper.
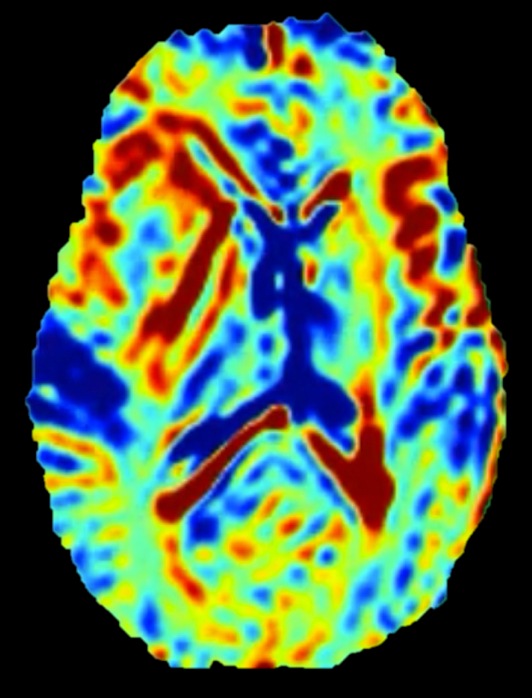
Dat ziet u hier rechts in beeld op een dwarsdoorsnede door de hersenen, waarop de rode gebieden een hoge suikeropname weergeven. Dit is nog uitermate experimenteel, en we moeten nu eerst vaststellen of dit ons dezelfde informatie geeft als een PET scan. De installatie van de volledig geintegreerde MRI-PET scanner op onze afdeling afgelopen maand biedt de uitgelezen kans om dit soort technieken één op één te vergelijken.
En dit is nog maar het begin. Binnen de Medical Delta van Rotterdam, Leiden en Delft werken we in een continue wisselwerking tussen klinisch,fundamenteel en technologisch wetenschappelijk onderzoek aan innovaties op het gebied van beeldvorming en beeldanalyse. De voorgenomen convergentie van het Erasmus MC met de TU Delft zet dit nog verder kracht bij.
Waarom we moeten tellen
Ten tweede, kwantificatie: we moeten niet alleen weten wat telt, we moeten ook kunnen tellen. Het is opvallend dat de radiologie, toch eigenlijk de wat beta kant van de geneeskunde, zo wars is van meten. En dan heb ik het niet over de grootte van een afwijking, daar leggen we wel een lineaaltje langs. Maar hier heb ik over het meten van de waarden binnen in ons beeld.
Waarom zouden we dat willen?
Het kwantificeren van beeldmateriaal, het uitdrukken van een grijswaarde in een getal, helpt ons op diverse manieren: ten eerste brengt het ons meer objectiviteit en uniformiteit: als we het er over eens zijn wat afwijkend is en wat normaal is, dan zijn we minder afhankelijk van de subjectiviteit van de beoordelaar, hetgeen nu vaak het geval is. Ten tweede, hogere gevoeligheid: met het blote oog is het lastig om kleine veranderingen of afwijkingen waar te nemen, terwijl die wel meetbaar kunnen zijn. En ten derde, een vlottere implementatie van nieuwe technieken. Het is altijd lastig om te wennen aan nieuwe beelden: je moet als het ware opnieuw leren hoe deze te interpreteren. Dat wordt een stuk eenvoudiger als de nieuwe techniek wordt geleverd met een lijstje van normaalwaarden. Als het klinisch-chemisch lab bijvoorbeeld een nieuwe test introduceert voor, zeg de nierfunctie, met begeleidende normaalwaarde, is deze in mum van tijd ingeburgerd. Dat hoeft voor ons niet anders te zijn.
Het probleem met kwantificatie is dat van oudsher MRI beelden niet kwantitatief zijn: de grijswaarden zijn verbonden aan arbitraire getallen, en meten kan dus niet. Hier en overal ter wereld wordt hard gewerkt aan kwantitatieve MRI technieken. Maar dit is niet eenvoudig. Iedere scanner heeft net weer een andere manier van het uitvoeren van deze metingen. Fysische constanten van weefsel zullen dus op verschillende scanners toch verschillende waarden geven. Het is te vergelijken met een thermometer die van het ene merk een andere waarde geeft dan het andere. Ondenkbaar natuurlijk, maar niet onoverkomelijk: zolang we maar weten wat de normaalwaarden zijn voor een scanner, of hoe te corrigeren tot een waarde die we allemaal accepteren, valt er prima mee te werken. En dat is de status die we nu al hebben: in veel gevallen valt er al met een referentiestandaard (fantoom) een kalibratiemeting te doen. Dat betekent dat wij, als radiologen, ook de volgende stap moeten zetten en zaken in maat en getal gaan uit drukken.
Big Data
En dan het derde en laatste punt: data, veel data. Denk aan de vele variaties waarmee een ziekte zich kan presenteren, en dan hebben we het pas over één ziekte. Al die variaties willen we in beeld hebben.
Dit kunnen we nooit bewerkstelligen binnen een enkel instituut. We móeten hiertoe samen werken, wereldwijd. Data moeten zoveel mogelijk publiek beschikbaar komen, uiteraard met inachtneming van patiëntenprivacy, maar alleen zo kunnen we stappen zetten. Want iedere dataset, iedere scan, levert ons een schat aan informatie. In het snel groeiende veld dat ‘radiomics’ heet, worden de beeldkenmerken die soms niet eens met het blote oog zichtbaar zijn, gevangen in maat en getal. honderden, zoniet duizenden beeldkenmerken kunnen zo worden gekoppeld aan eigenschappen van ziektes: de celdichtheid, de doorbloeding, de genetica.
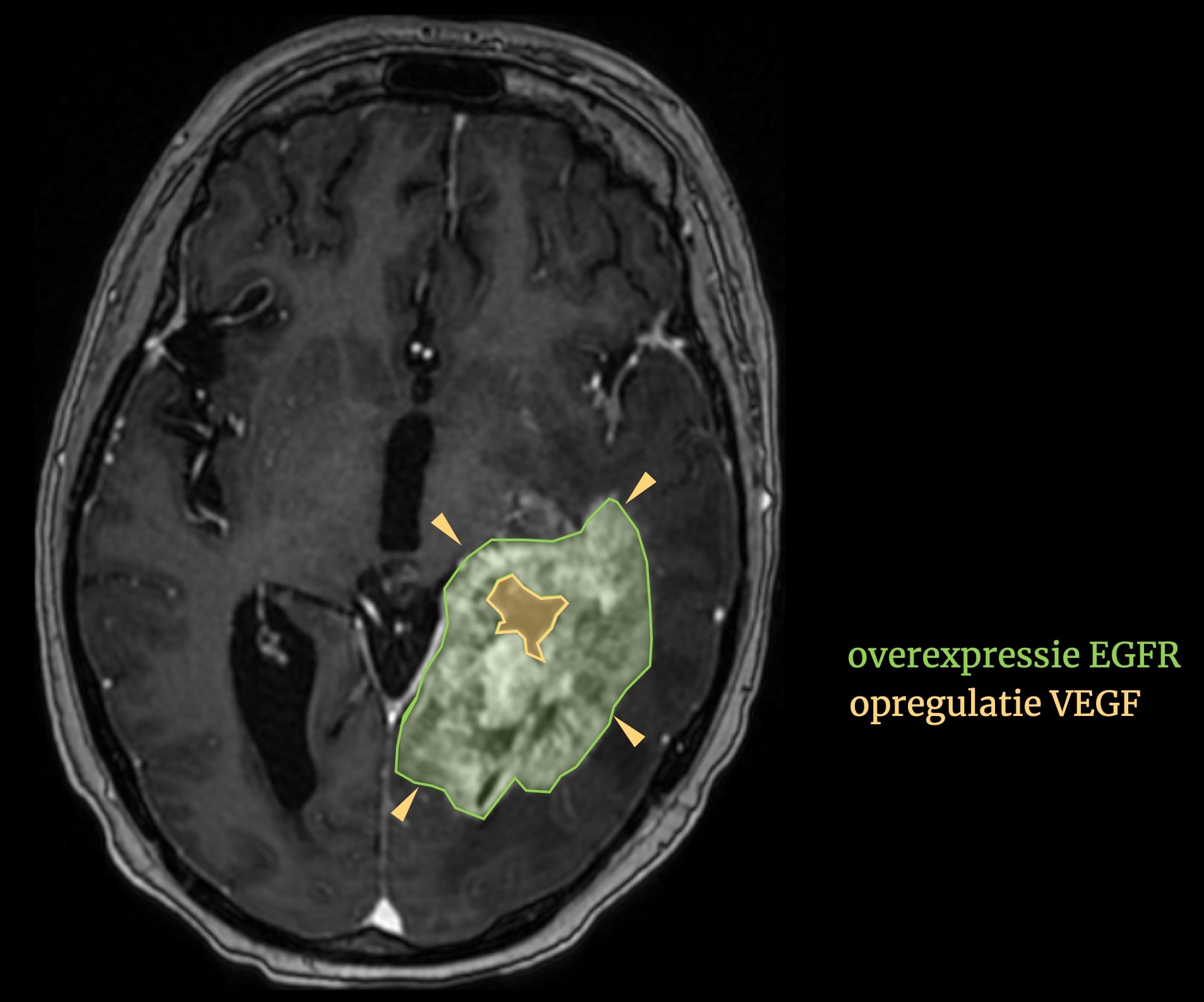
Zo is bijvoorbeeld de zogenaamde aankleuring van deze tumor geassocieerd met overexpressie van het epidermal growth factor receptor (EGFR) gen. En de necrose in de tumor met opregulatie van vascular endothelial growth factor (VEGF). De mogelijkheden zijn schier oneindig.
Samenvattend, met een combinatie van nieuwe technieken waarmee we ziekteprocessen accuraat kunnen afbeelden, de beelddata kunnen kwantificeren, èn uit zoveel mogelijk beelddata een enorme veelheid kenmerken kunnen halen, komen we een hele stap dichterbij het karakteriseren van ziektes op cellulair en moleculair niveau.
De uitstervende algemene radioloog
Eén belangrijke component mist nog: slimme rekenkracht.
Automatische beoordeling van beelddata en detectie en interpretatie van afwijkingen door de computer is onontkoombaar en sterker nog: noodzakelijk. Er is een voortdurende groei van de vraag naar beeldvormende diagnostiek. Ons vak verandert, en hoe verleidelijk het is om te denken dat dit iets is van onze tijd, dit is natuurlijk niet nieuw.
Maar, we zitten nu wel op een kantelpunt. We worden overladen met beelden: de hoeveelheid scans per persoon neemt exponentieel toe, en per scan neemt tevens de informatiedichtheid toe, zeker als we daar ook nog eens alle beeldkenmerken die we met radiomics verkrijgen bij optellen. Parallel hieraan is er een ware explosie van complexiteit van aandoeningen, behandelingen en procedures. Het officiële aantal unieke ziektecodes is op dit moment een gigantische 55.000. Dit is een meer dan vertienvoudiging in de afgelopen zeventig jaar, minder dan een mensenleven.
Er is daarom wat mij betreft geen plaats meer voor de zogenaamde algemene radioloog. Specialisatie en superspecialisatie zijn de enige manier waarop de radioloog bestaansrecht kan houden. Het argument dat ik vaak hiertegen hoor is dat het belangrijk is om de hele mens te beschouwen. Een ziekte beperkt zich immers niet per definitie tot één orgaan of tot een enkele ziekte, en treft een héle patiënt.
Dat is natuurlijk waar, maar ik vrees dat weinigen van ons in staat zullen zijn om alle kennis paraat te hebben om mee te kunnen praten op hetzelfde niveau als onze klinische partners. En dat is nou juist wat we wèl moeten kunnen en waar de gezondheidszorg steeds meer naartoe gaat. Want wij zijn natuurlijk niet uniek. Ook andere disciplines specialiseren zich steeds verder. Met als risico dat er geen overzicht meer is en niemand de terugkoppeling van zijn/haar werk ziet.
Chirurg, wetenschapper, en een van mijn favoriete schrijvers, Atul Gawande, stelt:
“Making systems work is the great task of our generation.”
Het is de opdracht van onze generatie om er zorg voor te dragen dat een complex systeem als de zich steeds verder versnipperende specialistische gezondheidszorg toch werkt.
De oplossing is niét om vast te houden aan de illusie dat we als algemeen radioloog de versnippering tegen kunnen of moeten gaan. Ik denk echter wèl dat wij als radiologen een belangrijke rol kunnen vervullen om een dergelijke complexe gezondheidszorg te laten werken, omdat vrijwel alle diagnostische informatie bij ons centraal binnen komt.
Hiertoe zie ik een belangrijke rol van computerondersteunde diagnostiek,of zelfs kunstmatige intelligentie. Deze kan ons op een slimme manier helpen het overzicht over de hele patiënt te behouden.
Ik denk daarbij wel dat kunstmatige intelligentie een grote bedreiging is voor het vak van radioloog zoals we dat nu kennen. Een bedreiging die we zeer serieus moeten nemen. Ik hoor nu vaak dat ‘wij ons geen zorgen hoeven te maken, want wij zijn de spin in het web die alle diagnostische informatie samenvoegt en zo presenteert aan de clinicus’. Dat is een geruststellende maar ook wel wat arrogante gedachte.
Want waarom leven we in de veronderstelling dat wij er als ‘diagnosticus’ altijd wel tussen zullen blijven zitten? De rol van integrator van diagnostische informatie hebben wij op dit moment ook niet: de behandelaar is degene die uiteindelijk alle informatie op een rijtje zet, de meest waarschijnlijke diagnose stelt, een behandelplan opstelt. Wij, radiologen, zijn er zo tussenuit gesneden als de computer het beter doet dan de gemiddelde, algemene radioloog.
De menselijke factor
Dat gezegd hebbende denk ik dat we als radiologen wel een kans hebben om ons in de toekomst staande te houden. De reeds genoemde toenemende complexiteit van de geneeskunde betekent dat het nemen van behandelbeslissingen niet meer bij één persoon ligt. Meer en meer worden belangrijke beslissingen genomen in het zogenaamde multidisciplinair overleg: alle betrokkenen komen samen en in samenspraak wordt de diagnose gesteld en een plan getrokken.

Een belangrijke reden om dit zo te doen is natuurlijk de genoemde complexiteit waarbij iedereen zijn of haar specifieke expertise inbrengt.
Maar er is nog een ander aspect, en dat is misschien nog wel veel belangrijker. Op dit moment is vrijwel geen enkele diagnose 100% zeker, geen enkele behandeling altijd de beste of de juiste.
“Medicine is decision making in the face of uncertainty.”
zegt mijn voormalig promotor Myriam Hunink.
Geneeskunde is het continue afwegen van voor- en nadelen tegen een achtergrond van meer of minder zekerheid. Dìt maakt ons vak zo moeilijk. Kunstmatige intelligentie kan ons helpen de veelheid aan kennis en informatie te integreren en de mate van onzekerheid inzichtelijk te maken. Maar de uiteindelijke afweging die leidt tot een beslissing is niet vanzelfsprekend. Zo’n beslissing neem je niet graag alleen, je deelt die verantwoordelijkheid, hoort de mening van anderen. Samen met de patholoog vervult de radioloog het diagnostische klankbord in het multidisciplinair overleg. En zolang er diagnostische onzekerheid is, zal die klankbordfunctie noodzakelijk blijven en de radioloog kunnen blijven bestaan.
Dat betekent niet dat we op onze lauweren kunnen rusten en denken dat het hiermee wel goed komt. We moeten meegaan in de ontwikkelingen van ons vak: we moeten de meest geavanceerde technieken weten in te zetten en te gebruiken. Technische kennis dus, op het grensvlak van techniek en patiëntenzorg, een klinische gesprekspartner van de klinisch technoloog, fysicus en computer wetenschapper aan de ene kant, en van het behandelteam aan de andere kant. Meer techniek in de opleiding dus, maar ook diepgaande kennis van het klinische vakgebied: super super specialisatie.
Let wel, ik zeg hier niet dat ons werkveld zich moeten beperken tot super-gespecialiseerde centra. Integendeel. Ik wil er juist voor pleiten dat alles wat ontwikkeld wordt in ons zogenaamde MRI laboratorium breed wordt ingezet. Anders hebben we wel mooie beelden, maar ze tellen eigenlijk niet mee.
De weerbastige werkelijkheid van de klinische praktijk
In de klinische praktijk maken we echter maar mondjesmaat gebruik van alles wat er nu al mogelijk is. En in de wereld van klinische trials leven we qua beeldvorming nog in de jaren tachtig van de vorige eeuw; er wordt enkel gebruik gemaakt van structurele, anatomische beelden: hooguit zijn deze nu van wat hogere resolutie, maar in essentie is deze beoordeling in de afgelopen ruim dertig jaar ongewijzigd. Dit is des te schrijnender, omdat klinische trials juist gericht zijn op het ontwikkelen en testen van nieuwe behandelingen. Beeldvorming is hierin extreem belangrijk, omdat het effect van de behandeling vrijwel altijd beoordeeld wordt met beeldvorming. Hoe problematisch dat kan zijn, wil ik aan de hand van twee voorbeelden laten zien.
Het eerste voorbeeld betreft een nieuw middel om de meest agressieve hersentumor, het glioblastoom, mee te behandelen. Dit middel werkt de vorming van nieuwe bloedvaten tegen, het proces dat de tumor juist nodig heeft om te groeien. De gedachte is, dat je door die bloedvatvorming tegen te gaan, de tumor als het ware laat versterven.
Hier ziet u een voorbeeld van behandeling met dit middel.
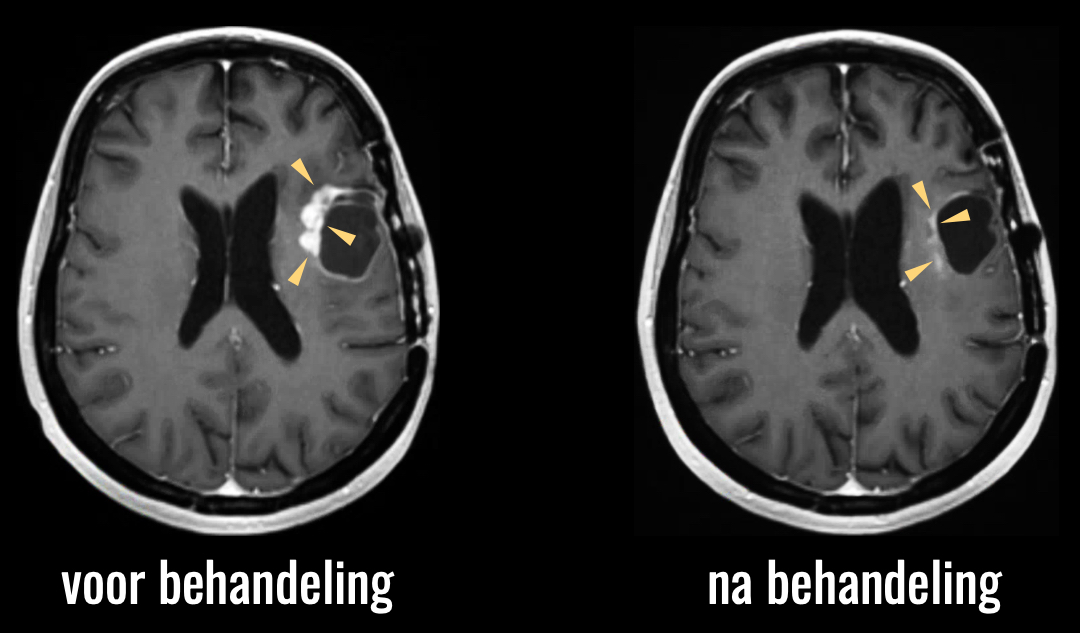
U ziet, de tumor verdwijnt als sneeuw voor de zon. Deze resultaten van de eerste klinische trial waren zo indrukwekkend dat het middel in 2009 in de Verenigde Staten versneld tot de markt werd toegelaten. Later bleek echter dat patiënten die behandeld waren met dit middel niet langer leefden dan diegenen die een standaard behandeling hadden gekregen. Dit lijkt een tegenstelling. Maar wat men zich niet had gerealiseerd, is dat deze eenvoudige scans alleen maar het hele indirecte effect van de tumor laten zien: de lekkage van ingespoten contrastmiddel door de bloedvaatjes van de tumor. Die vaatjes waren door het middel verdwenen, dus de lekkage was niet meer zichtbaar op de scan. Maar de tumor zelf, die meer is dan alleen maar dit effect, bleek gewoon door te groeien, onzichtbaar op deze gewone scans.
Wat we dus zien op de MRI scan is een zogenaamde pseudorespons. Tot op de dag van vandaag hebben we nog geen goede manier om het effect van dit soort behandelingen met beeldvorming te evalueren.
Het tweede voorbeeld betreft het omgekeerde effect, namelijk pseudoprogressie. Dit is denk ik het grootste diagnostische dilemma in de neuro-oncologische follow-up. De behandeling van een hersentumor kan namelijk leiden tot een reactie van het omringende hersenweefsel, die er op een MRI scan precies hetzelfde uitziet als de tumor zelf. U ziet hier de scan van een patiënt die behandeld is met de standaardbehandeling van bestraling en chemotherapie.
U ziet de sterke toename van afwijkingen na de behandeling.
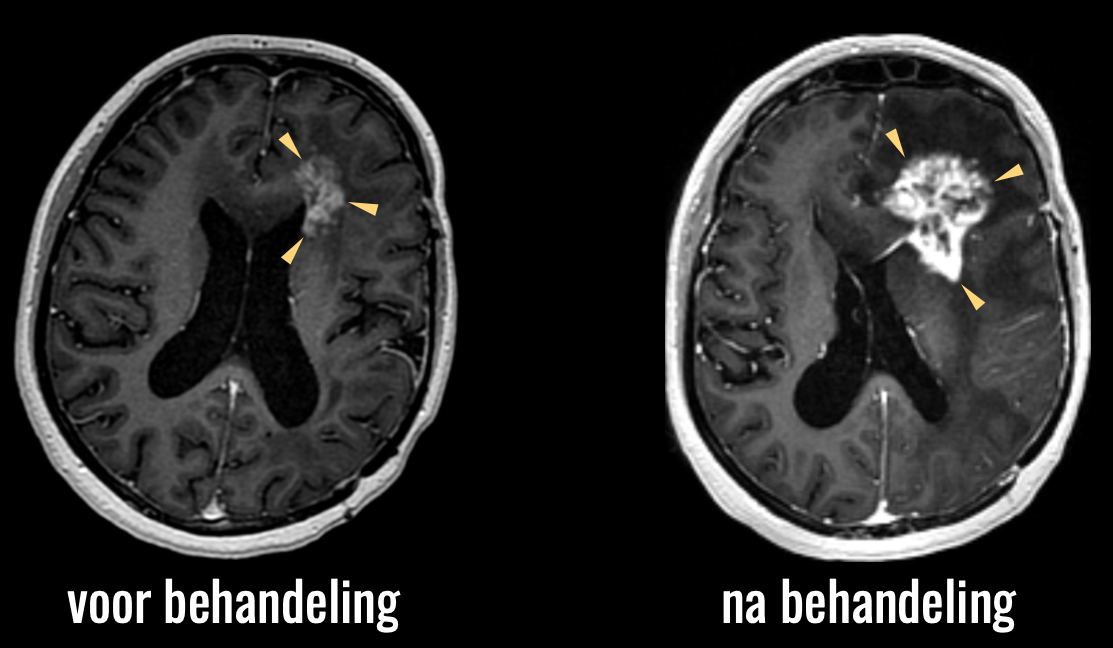
Op basis van deze beelden kunnen we niet zeker zeggen of er hier sprake is van toename van de tumor, of een reactie van het omringende hersenweefsel op de behandeling, en dus niet een toename van de tumor. Vaak is de enige optie om maar af te wachten hoe de afwijkingen zich verder ontwikkelen, met alle onzekerheid van dien, zowel bij dokter als patiënt, en natuurlijk een hoe dan ook suboptimaal beleid: als we niet weten wat er aan de hand is, kunnen we ook niet weten hoe we verder moeten handelen.
In de klinische praktijk maken we hiervoor vaak gebruik van fysiologische beeldvorming.
Hier zien we dat de toename van afwijkingen gepaard gaat met een lage doorbloeding, blauw in beeld: dit is dus geen tumor, maar het effect van behandeling: pseudoprogressie.
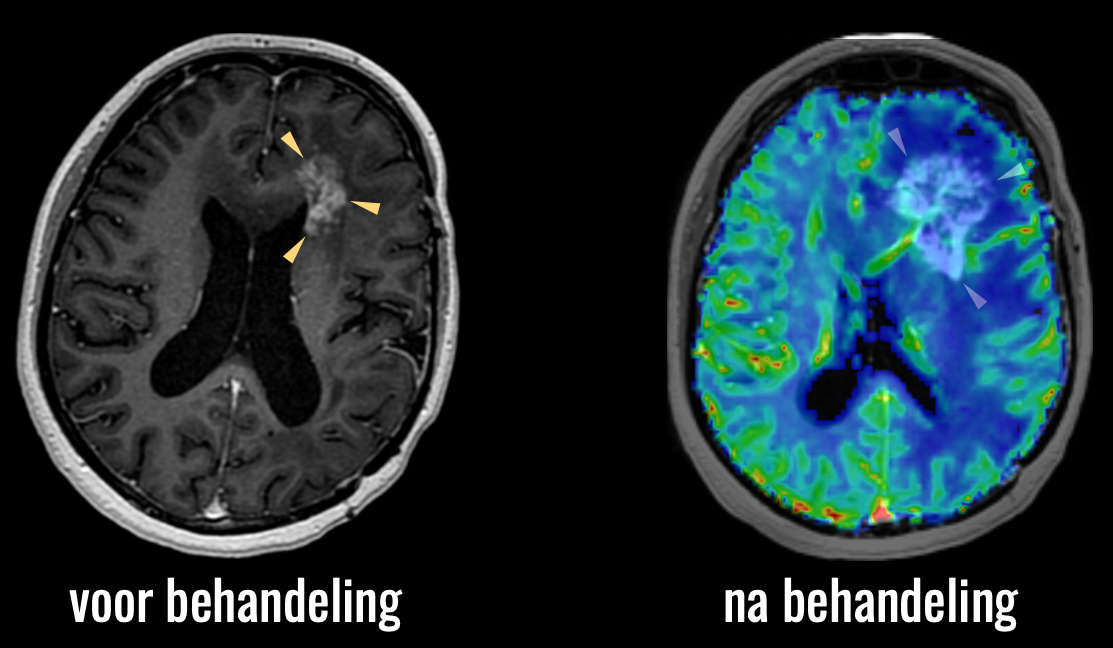
Op de scan die 3 maanden later is gemaakt, ziet u dat de afwijkingen inderdaad vanzelf weer zijn afgenomen, dus zonder dat een aanvullende behandeling nodig was.
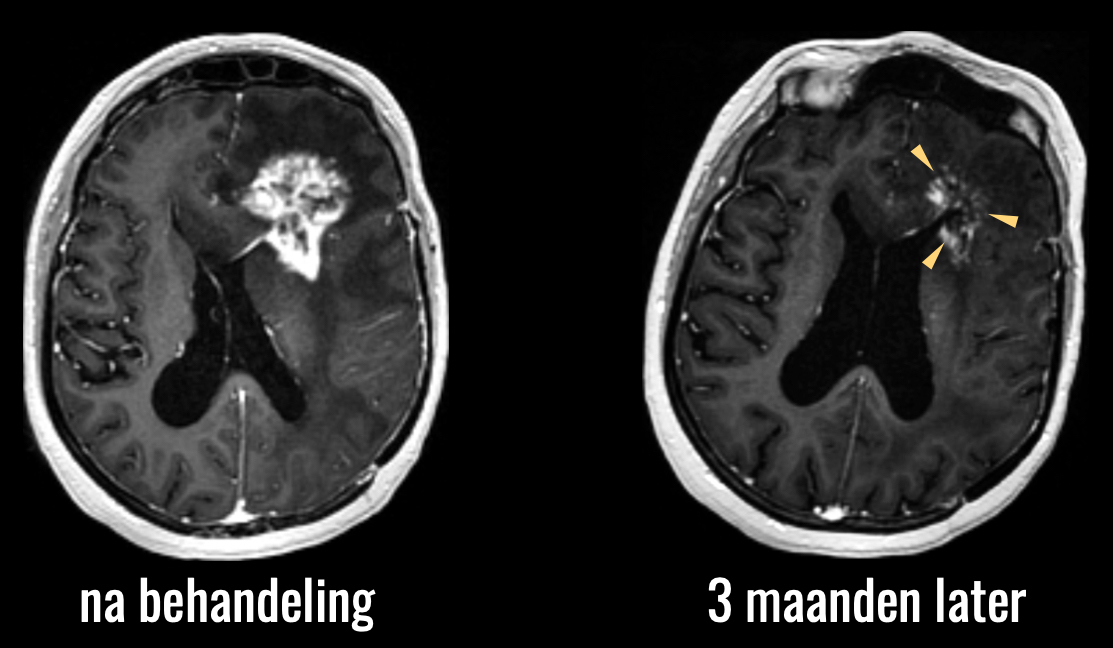
Met de fysiologische beeldvorming konden we dus al wel een onderscheid maken tussen tumorprogressie en een behandeleffect, pseudoprogressie. Deze technieken zijn echter nog niet doorgedrongen tot de wereld van de klinische trials en dat betekent dus, dat we van nieuwe behandelingen vaak niet goed kunnen vaststellen of ze werken of niet. Het is een van mijn doelen om dit soort technieken wel beschikbaar te maken, via mijn werk binnen de grootste Europese wetenschappelijke organisatie voor onderzoek naar kanker: de European Organisation for Treatment and Research of Cancer (EORTC). En niet alleen daar. Zoals gezegd gaat het beeld pas echt tellen als we daar niet alleen in superspecialistische centra mee werken, maar ook daarbuiten, daar waar natuurlijk ook vele patiënten worden behandeld.
Hoe pak ik dat aan?
De weg naar implementatie
Ten eerste is een kritische beschouwing van mijn werkveld op zijn plaats. In deze wervelwind van technologische innovatie is het verleidelijk om ons tot grote hoogte mee te laten voeren in alle mogelijkheden, naar de spreekwoordelijke sky die de limit lijkt te zijn. Immer voorwaards, maar laten we niet vergeten ook achterom te kijken.
Het is tijd dat ons vakgebied wetenschappelijk volwassen wordt. Vrijwel al het onderzoek naar nieuwe beeldvormende technieken bevindt zich in de lagere zones van bewijskracht. Gerandomiseerd onderzoek, de hoogste standaard van klinisch-wetenschappelijk onderzoek, is in de diagnostische radiologie een zeldzaamheid. Verder moeten we ons niet alleen richten op de vraag of een nieuwe techniek diagnostisch beter is dan de gangbare techniek, maar ook of deze een daadwerkelijk effect heeft op de klinische besluitvorming. Wordt er bijvoorbeeld minder aanvullend onderzoek gedaan? Wordt er sneller een behandeling ingezet? En heeft dit dan ook daadwerkelijk effect op de patiënt: sneller herstel, betere overleving? Ik ben er heel trots op dat we dit in landelijk verband onderzoeken op het gebied van perfusie MRI in het PERISCOPE project, samen met de Landelijke Werkgroep NeuroOncologie en de Nederlandse Vereniging voor Radiologie.
Ten tweede, educatie. Onbekend maakt onbemind, en in een drukke klinische praktijk hebben we nu eenmaal niet de tijd om ons ook nog eens in iets nieuws te verdiepen. Onzekerheid over implementatie en interpretatie belemmeren toepassing in de klinische praktijk. Dit geldt niet alleen voor de radiologische praktijk, dit geldt voor het gehele behandelteam. Ook hier geldt dat een betere integratie van techniek in het curriculum van de radiologische opleiding zou kunnen helpen. En laten we patiënten zelf niet vergeten: ook zij zijn graag geinformeerd over nieuwe technieken waarmee hun ziekte geevalueerd kan worden.
Ten derde, harmonisatie. Vraag vijf radiologen om tot een bepaald scanprotocol te komen en je krijgt evenzoveel variaties voor een en dezelfde indicatie. Zelfs kleine variaties in scanprotocollen maken een vergelijking lastig, met als vermoedelijk grootste probleem dat kleine verschillen niet kunnen worden gedetecteerd. Wanneer patiënten worden verwezen naar een ander ziekenhuis, wordt onderzoek daarom vaak over gedaan. Daarnaast is het moeilijk om voor wetenschappelijk onderzoek data van verschillende instanties samen te voegen.
Wat het effect van harmonisatie is, blijkt uit recente successen van de EORTC met het samenvoegen van beelddata. Ongeveer tien jaar geleden hebben we een scanprotocol opgesteld dat door alle centra binnen Europa kan worden uitgevoerd. Nu plukken we daar de vruchten van, met resultaten die echt baanbrekend zijn in de wereld van neuro-oncologische beeldvorming.

En tenslotte, samenwerking. In samenwerking bundelen we onze krachten, leren we van elkaar. Hiertoe wil ik verwijzen naar de zeer indrukwekkende toespraak die Tessa Jowell, Brits politica en zelf gediagnosticeerd met een hersentumor, gaf in het Engelse hogerhuis.
Ze zei onder andere:
“So many cancer patients collaborate and support each other every day.
All we now ask is that doctors and health systems learn to do the same.
Learn from each other.”
Als patiënten elkaar weten te vinden en ondersteunen, dan is het wat mij betreft onze plicht als artsen en wetenschappers in de gezondheidszorg om hen daarin te volgen en ervoor te zorgen dat we samenwerken en van elkaar leren.
En laten we ons daarbij niet beperken tot samenwerking binnen ons eigen instituut, ons eigen land, of ons eigen vakgebied. Grenzen vervagen – niet alleen tussen landen maar ook tussen vakgebieden. En dat is goed! We moeten niet krampachtig vasthouden aan een gezondheidszorg structuur die honderd jaar geleden is ontstaan. Hoe pijnlijk het ook is, een herdefinitie van ons vakgebied is aan de orde.
Het beeld dat telt
Concluderend: Wat zorgt er nu voor dat het beeld telt? Enerzijds technologische hoogte, anderzijds toegankelijkheid. Dit is niet onverenigbaar.
Een beeld dat telt geeft ons alle informatie die we nodig hebben: niet alleen structuur, localisatie, maar ook functie, fysiologie en op den duur misschien zelfs wel een gouden standaard voor diagnostiek waardoor we geen invasieve procedures meer nodig hebben om een diagnose te kunnen stellen. Ervoor zorgen dat we kunnen tellen, kwantificeren, en onze beelden bij elkaar op kunnen tellen.
En tenslotte, dit alles is niets waard als dit beperkt blijft tot een klein groepje mensen dat toevallig toegang heeft tot een specialistisch centrum in een rijk stukje van de wereld. Toegankelijkheid leidt niet alleen tot een betere globale gezondheidszorg en gezondheid, maar ook tot grote wetenschappelijke voordelen, waarin we onze krachten en beelden kunnen bundelen en de rijkdom aan diversiteit kunnen uitbuiten. Kunstmatige intelligentie kan ons vak en zelfbeeld dan wel bedreigen, maar het kan ons ook helpen hoog-specialistische zorg breed in te zetten.
In een wereld waarin haat en onverdraagzaamheid niet alleen de kop op steken maar zelfs toenemend getolereerd worden en er zelfs binnen ons rijke Nederland postcode ongelijkheid van gezondheid is, moeten we onze inzet juist verdubbelen om samen te werken, humaniteit tonen, en de wereld een beetje beter te maken.
Want dàt is uiteindelijk wat telt.
Dankwoord
Met enige gêne sta ik hier, in mijn eentje, in de wetenschap dat dit enorme podium lang niet groot genoeg is voor alle mensen die me hier hebben gebracht.
Mijn dank gaat in de eerste plaats uit naar het Erasmus Trustfonds, de Raad van Bestuur van het Erasmus MC en het College van Bestuur van de Erasmus Universiteit Rotterdam voor het mogelijk maken van deze leerstoel. Verder wil ik heel graag alle mensen bedanken die het doen van onderzoek mogelijk maken: de subsidiegevers, de donateurs, de vrijwilligers, de deelnemers.
Mijn enorme dank gaat verder uit naar mijn afdelingshoofd, mijn voormalig opleider, en mentor Gabriel Krestin. Van jou kreeg ik de ruimte om me te ontwikkelen, mijn klinisch werk en wetenschap intens met elkaar te verweven, op een afdeling waarop dankzij jou onderzoek professioneel wordt ondersteund. Jij bent mijn grote voorbeeld in internationaal leiderschap en visie. Heel veel dank voor je vertrouwen in mij en voor al je steun in de afgelopen jaren.
Onze afdeling radiologie en nucleaire geneeskunde, het is me zo’n voorrecht om hier te werken. Ruim 19 jaar geleden kwam ik hier binnen, door jullie ben ik opgeleid, grootgebracht, en heb ik zoveel steun gekregen om mijn onderzoekslijn op te zetten en te laten groeien. Ik sta … op jullie schouders. Dank aan allen van het research office en trialbureau, het afdelingsbestuur, de ICT radiologie, het themabureau, technici, administratie, doktersassistenten, collega-staf en aiossen. Sita Ramman, Sylvia Bruininks, Hanneke Muharam en alle andere laboranten, in het bijzonder op de MRI. Het stafsecretariaat, en dan natuurlijk m.n. Priscilla van Andel: mijn rots in de branding van de alledaagse chaos.
Ik bedank natuurlijk ook graag mijn voormalig promotor, Myriam Hunink. Jij hebt me tot zelfstandig onderzoeker opgeleid, en ook in de jaren erna stond je me als mentor terzijde.
Mijn naaste collega’s in de neuroradiologie: Aaike van den Berg, Mayke Gardeniers, Edwin Oei, Anke van der Eerden, Loes Braun, Habib Ahmad, Ad van Es, Pieter Jan van Doormaal, en natuurlijk mijn grote leermeester: Hervé Tanghe. Aad van der Lugt, dank voor je altijd luisterend oor en kritische blik, mentorschap en vriendschap. Meike Vernooij, een half jaar geleden stond jij hier, wat was het geweldig om deze weg met jou als collega èn vriendin samen af te leggen.
En dan natuurlijk mijn onderzoeksgroep, my research group. Esther Warnert, wat ben ik blij en vereerd dat jij koos voor mijn groep voor je post-doc. Mijn alumni: Janne Papma, Carolina Mendez, Rebecca Steketee, Esther Bron, Rozanna Meijboom en Renske Gahrmann. Geweldig om te zien hoe jullie als zelfstandig onderzoekers jullie weg vervolgen. En natuurlijk, mijn promovendi, my PhD students: Fatih Incekara, Sebastian van der Voort, Karin van Garderen, Yulun Wu, Fatemeh Arzanforoosh, Wouter Teunissen, as well as all research fellows and Masters students over the past years: you are the literal heart and soul of my research. Stay true to your ideals and ambitions and keep chasing your dreams. We depend on you for our future.
Alles wat ik heb bereikt is zonder uitzondering het resultaat van samenwerking met de meest geweldige mensen en onderzoeksgroepen. In de eerste plaats is dit de Biomedical Imaging Group Rotterdam, onder leiding van Wiro Niessen. Veel dank voor onze inspirerende samenwerking en je vriendschap de afgelopen jaren. Stefan Klein, het is fantastisch om samen onze promovendi te begeleiden.
Ook essentieel is de MRI fysica groep van onze afdeling, the MRI physics group led by Juan Hernandez Tamames. Thank you all for our work together.
En dan, het Erasmus MC Hersentumorcentrum. Wat ben ik onder de indruk van ieders enorme inzet op wetenschappelijk, klinisch èn menselijk vlak. Martin van den Bent, het is een eer en een zeer groot genoegen om met jou samen te werken, dank je wel voor je warme welkom in jóuw wereld van de neuro-oncologie. Clemens Dirven, Arnaud Vincent, Joost Schouten, Irene van Heuvel, Jacoline Bromberg, Sieger Leenstra, Pim French, Max Kros, Maarten Wijnenga, Matthijs van der Meulen, Jaap Jaspers, Wies Vallentgoed, Erik Jan Dubbink, Theo Luider, Sandra Mendez, Astrid van der Veldt, veel dank aan jullie en aan alle anderen die ik nu niet bij naam heb kunnen noemen.
Ik wil ook graag het Alzheimercentrum bedanken, waarbinnen ik veel van mijn eerdere onderzoek heb gedaan, voordat ik mij volledig ging richten op de neuro-oncologie.
Mijn dankbaarheid reikt ook tot buiten, ver buiten, de grenzen van het Erasmus MC. De Medical Delta begint steeds meer mijn ‘thuis’ te worden, waarvoor dank, met name aan Sjoerd Stallinga van de TUDelft en Thijs van Osch van het LUMC.
Veel dank aan Linda Dirven van het LUMC en Anouk van der Hoorn van het UMCG, bij het opzetten van het landelijke PERISCOPE project, waarvoor ik ook veel dank verschuldigd ben aan de Nederlandse Vereniging voor Radiologie, de Landelijke Werkgroep NeuroOncologie en vele anderen.
Neuroradiologisch Nederland (en België), ik vóel letterlijk jullie steun in de rug, dank jullie wel.
Op internationaal vlak wil ik de EORTC noemen, evenals de internationale MRI en de neuroradiologische gemeenschappen. Many thanks to my international collaborations with the MRI physics group at King’s College London, and with the Neuroradiology department of the National Hospital for Neurology and Neurosurgery at Queen Square.
Graag bedank ik verder mijn industriële partners, GE Healthcare en Quantib, die ervoor zorgen dat we enerzijds toegang hebben tot hun nieuwste producten en er anderzijds voor kunnen zorgen dat onze experimentele versies de wijde wereld in kunnen.
Dan, op het grensvlak van werk en privé: Winnifred van Lankeren. Collega, vriendin, familie. Jouw hart is groter dan deze wereld, en toch heb je ook nog ruimte voor mij. Ik ben je diep dankbaar voor jouw generositeit en onze vriendschap en natuurlijk ook voor je goede zorgen vandaag als mijn ceremoniemeester.
Lieve vrienden en familie, my dear friends and family. Thank you for your love, friendship, and support. Thank you for having me in your lives and for celebrating this moment here together with me.
Marc en Marijne, mijn broer en zus. Het was een voorrecht om met jullie op te groeien. Heel veel dank aan jullie, en aan jullie partners, Marianne en Tim, en kinderen, Olaf en Benthe en Myrthe en Alex, voor de onvoorwaardelijke warmte en liefde van onze hechte familiebanden.
Frans en Frieda, mijn ouders, jullie zijn mijn inspiratie en deze dag is een eerbetoon aan jullie. ‘Slim zijn is op zichzelf geen verdienste’, zeiden jullie toen ik opgroeide, ‘Het gaat erom wat je ermee doet’. Ik doe daar hier graag nog een schepje bovenop, want ook een hoogleraarschap is voor een belangrijk deel op de juiste plek zijn met de juiste mensen om je heen en mooie kansen krijgen die zich toevallig voordoen. Heel hard werken, dat wel, maar nog steeds: het gaat er uiteindelijk om wat je ermee doet. En dat zal ik proberen eer aan te doen.
Peter Hilton, my partner. I never tire of talking to you, hearing your thoughts and insights, forever inspiring and challenging me. I could not have done this without you. Thank you, with all my heart.
Ik heb gezegd.
